继锂硫电池之后,人们发现镁硫电池也具有更高的理论比能量,并且由廉价和更环保的电极材料组成。
然而,与锂硫电池相比,目前的镁硫电池存在着镁阳极过电位较高、硫阴极材料利用率和可逆性较低、对电解质需求过大等问题。
镁硫电池的介绍
可充电的金属硫电池,如Li-S、Na-S、K-S、Al-S、Ca-S和镁质锂电池,使用硫磺作为正极,比典型的锂离子电池(LIBs)基础、钴基、锰基和镍基正极材料更加丰富和可持续。
此外,由于硫和金属阳极的高容量,电池系统具有很高的理论比能量,锂硫电池(LSB)(2654Wh kg-1和2856Wh L-1)和镁锂电池(镁硫电池)(1684Wh kg-1和3221WhL-1)。
尽管过电位和活性材料的不完全利用以及大比例的电解质和其他非活性材料大大降低了实际LSB和镁硫电池的比能量,但这两个系统有可能类似于甚至高于LIB。
在LSB的情况下,昂贵的和当地有限的锂作为阳极材料(金属锂箔至少250美元/公斤,地壳中18ppm,海水中0.2g m-3)的组合抵消了S阴极的成本优势。
镁硫电池使用廉价和全球丰富的镁作为阳极材料(金属镁2.5美元/公斤,在地壳中占2.2%,在海水中占1公斤/立方米),因此,镁硫电池更具吸引力,因为它可能更具成本效益,具有更高的元素丰度和材料可及性,是LIB和LSB的更可持续的替代品。

与碱金属和钙金属阳极不同,镁阳极的标准还原电位(-2.36V对标准氢电极,SHE),对液体电解质的稳定性特别高。
因此,在许多电解质系统中,特别是在循环伏安实验中,主要观察到无表面层的阳极和可逆的镁电沉积/剥离库伦效率高达99.9%。
而对于Li、Na、K和Ca金属,相对于SHE,其较低的标准电极电位分别为-3.04V、-2.71V、-2.92V和-2.87V,导致常用的有机电解液的热力学不稳定。
锂金属阳极的持续腐蚀可通过固体电解质间相(SEI)或应用固体电解质保护来缓解。
然而,在Na和K阳极上,由于含Na+和K+的SEI成分的高溶解度,保护性SEI变得复杂。Ca阳极(-2.87V对SHE),电解质分解和表面膜的形成导致Ca电沉积/剥离的高过电位,甚至使电极完全钝化。
锂和镁金属阳极的特点
锂和镁在周期表中处于对角线关系。因此,一些化学性质是相似的,例如在燃烧过程中形成单氧化物,它们对氮的反应性,以及它们的碳酸盐在加热时的化学不稳定性。然而,正如下文所讨论的那样,它们作为电池单元中的金属阳极的特性差别很大。图1和图2总结了LSB和硫磺镁电池中阳极所面临的挑战。
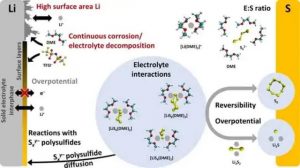
如红色所示,研究重点应放在缓解锂金属阳极的持续腐蚀上,这种腐蚀因高表面积的锂沉积而被放大。分子结构包括Li(灰色),S(黄色),O(红色),C(青色),H(白色),和N(蓝色)。一个被阻断的通道用红叉标记。分子结构重绘自Bieker等人。
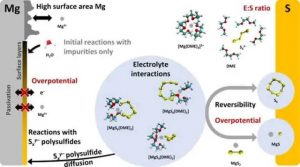
图2:镁硫电池的主要特点和挑战总结。
如红色所示,研究应着重于降低镁阳极和S阴极的高过电位,以及实现低E:S比率。分子结构包括Mg(灰色)、S(黄色)、O(红色)、C(青色)、H(白色)和N(蓝色)。封锁的通道用红叉标记。分子结构重绘自Bieker等人。
硫磺锂电池和硫磺镁电池的电解质
由于锂的标准电极电位与SHE相比低至-3.04V,金属锂对常用的液体有机电解质在热力学上是不稳定的。
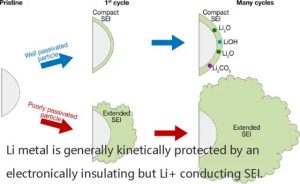
为了减缓持续的腐蚀,以减缓阳极的自放电和电解质的降解,金属锂一般由电子绝缘但Li+导电的SEI进行动力学上的保护。
为了补偿锂电沉积和剥离过程中的体积变化,并抑制高表面积锂(HSAL,通常被称为异种或树枝状锂)的形成,SEI还必须是稳定的、灵活的和均匀的。
SEI在锂金属阳极上形成真正的长期保护已经研究了几十年,对于包括LSB在内的锂金属电池系统来说,仍然是一个未解决的挑战。
为了补偿锂金属阳极与电解液的反应性,LSB电池需要过量的锂金属和大量的电解液。后者通常具有较高的E:S比率。
相比之下,对于镁硫电池的电池阳极,相对于SHE标准电极,电位为-2.36V,在许多电解质系统中具有高度稳定性。在循环伏安实验中,Mg电沉积和剥离的库仑可逆性可以达到99.9%。
因此,表面膜对Mg的潜在动力学保护作用并不像上述对Li、Na、K和Ca阳极的影响那样重要。然而,在一些电解质系统中,这样高的库仑可逆性只能在一定数量的Mg电沉积和剥离循环后才能实现。
在这个所谓的 “调节 “过程中,不可逆的容量对应于电解质中HO或其他可还原杂质的减少。在含有AlCl3的电解质中,不可逆容量也可能对应于AlCl2+或其他AlClx物种对Mg的腐蚀。
因此,不可逆容量可以通过用金属镁预处理电解质或直接用优化的化学计量制备电解质并加入还原性物种如Bu2Mg来避免。
镁和锂的电沉积和剥离行为的巨大差异源于Li+和Mg2+阳离子的特性。与Li+相比,Mg2+阳离子的高电荷密度的强静电作用反映在Mg电解质的离子传导率低于Li电解质(≈5 ~ 15 mScm-1)(通常< 5 mScm-1)。
尽管具有弱配位阴离子的镁基电解质显示出与锂基电解质相当的离子传导性(例如,四(六氟异丙氧基)硼酸镁(Mg[B(hfip)4]2)高达11 mS cm- 1)。
这种相互作用进一步抑制了Mg2+在固体中的合理流动。因此,界面层的出现,例如来自电解质成分或杂质的分解,减缓了Mg2+的电沉积和剥离,甚至可能使离子传输的电极钝化。因此,镁硫电池研究的主要方法是保持镁阳极表面的裸露和无钝化。

除了选择对金属镁稳定的电解质成分外,这可能需要减少杂质清除剂,如以前使用的格氏材料、少量的Bu2Mg,或用金属镁进行电解质预处理。
相对于Mg/Mg2+电位而言,0V以上的还原电流以及在上述 “调节 “过程中Mg电沉积和剥离的过电位持续降低表明了电化学 “净化”。这里,过电位的降低也被认为与Cl-物种的形成有关,它可以从Mg阳极上去除表面层,抑制杂质的进一步吸附和分解。
此外,Mg2+与电解质溶剂的强配位导致了高的解溶能垒,导致了Mg电沉积的过电位。同样地,Mg2+阳离子的高脱溶能垒减缓了Mg2+插入阴极材料的速度。
为了降低这些过电位,有必要削弱Mg2+阳离子的溶剂配位,例如,将Mg2+转移到Mg2Cl3+、Mg2Cl22+或其他MgxClyz+复合物中。
一些含氯的镁电解质对电池外壳或铝制集电器的部件有腐蚀作用,需要用涂层保护或用抗腐蚀材料代替。
锂和镁金属阳极的沉积形态比较
在比较锂和镁金属阳极的沉积形态时,人们常说,锂会出现HSAL甚至树枝状的形成,而镁的电沉积是均匀的,没有树枝状的。对于锂金属阳极,发现沉积物具有苔藓状、针状、结节状或颗粒状的形态。
对于镁-锂电池阳极,沉积物大多被描述为金字塔形或六角形结构。Matsui对锂和镁在不同电流密度下的电沉积和溶解的比较研究说明了这种差异。
不同的沉积形态主要是由镁电极上干净的、无表面的薄膜来解释的,与通过金属锂上的多组分SEI的非均匀电流分布相比,它导致了更均匀的电流分布。当锂电沉积和溶解的体积发生变化时,SEI断裂,未受保护的锂表面就会暴露出来。

这导致整个电极表面的电流分布更加不均匀,导致性能和安全性下降。通过暴露出未受保护的锂,这种机制加速了电极腐蚀。为了抑制这两者,需要一个稳定、灵活和均匀的SEI。
对于镁硫电池阳极,与金属锂相比,镁的沉积更均匀的趋势进一步归因于镁的低表面扩散屏障。此外,据推测,在镁电沉积后,电解液中活性镁物种的局部耗竭产生了均匀分布的镁成核表面。
这个想法引起了镁电解质的离子电导率(通常<5 mS cm-1),与它们的Li对应物(≈5~15 mS cm-1)相比,更加异质的Li沉积。 支持。
尽管少数Mg电解质表现出更高的离子传导性(例如,Mg[B(hfip)4]2高达11 mA cm-1)。同样地,同质电沉积过程可以用Mg物种的脱溶的动力学障碍来解释。
锂硫电池与镁硫电池的安全问题
除了金属锂阳极的腐蚀加剧外,HSAL的形成,特别是锂树枝状物的形成,会导致内部短路的风险,因为它们通过隔膜生长并到达阴极。尽管在硫磺镁电池的金属阳极的情况下,形成树枝状物的趋势很低,但与锂电池相比,镁树枝状物的高硬度和硬性也增加了金属镁电池的内部短路的风险。
就金属锂而言,与水分和空气的高反应性、180℃的低自燃温度和181℃的低熔点都导致了安全问题。相比之下,金属镁的自燃温度高达473℃,熔点为650℃。以镁箔的形式,它在室温下与水分和空气接触时将会钝化。然而,金属镁是高度可燃的,因此也应被认为是一个潜在的安全风险。
在含Li+或Mg2+的多硫化物溶液的循环伏安实验中,也观察到了硫磺阴极的电化学行为的阳离子依赖性差异。
在DME中的Li2S8和LiTFSI溶液中,硫的还原是通过形成S42-和S22-进行的,而在DME中的MgS8/MgTFSI2中则观察到直接还原S22-。
为了评估放电反应第一步的高电压,并允许在充电过程中逐渐氧化,多硫化镁物种的形成应该是稳定的。由于这种稳定性是由电解质阳离子与多硫化物阴离子的静电作用决定的,它可以通过阳离子的有效溶剂配位来调整。
在相对介电常数较高的溶剂中,如二甲基亚砜(DMSO)或二甲基甲酰胺(DMF),观察到多硫化锂和多硫化镁的溶解度较高,比例失调较少。因此,锂和镁电解质中硫的还原是通过形成低电荷密度的S82-/S62-(阶段1)和高电荷密度的S42-/S32-物种进行的。
尽管这些特殊的溶剂被认为会使镁阳极钝化,但研究结果说明了更强的溶剂配位的有利影响。
过电位、放电能力和可逆性
LSB在放电过程中通常显示出约2.1V的平均电压,而在充电过程中观察到的平均电压为2.3V。由于锂金属阳极的过电位相对较低,这种电压滞后几乎完全对应于硫磺阴极转换反应的过电位。
因此,硫磺阴极相对于Li│Li+参比电极的电位很大程度上对应于在双电极锂-S电池中检测到的电压。相反,由于镁阳极的过电位较高,镁硫电池电池中的电压与硫阴极的电位变化很大。
在放电过程中,S正极的平均电位为1.4-1.5V,在充电过程中,相对于Mg│Mg参考电极测量的平均电位为1.8-1.9V。因此,硫磺镁电池中S阴极的充放电反应往往在比LSB高得多的过电位下进行。
在这两个系统中,硫在碳主结构中的电子接触不足,导致放电过程中出现过电位。在固体S22-和S2-物种成核之前,多硫化物的过饱和也被认为是造成硫磺镁电池过电位的原因。

由于多硫化锂物种在液相中的过饱和可能会降低放电容量或完全中断放电过程,因此LSB需要大量的电解质,通常用E:S比率表示。由于多硫化镁的溶解度低,硫磺电池可能会更快地达到局部过饱和。这可能就是为什么通常研究的E:S比为60:1或更高。
在放电反应的最后一步,过电位归因于无定形Li2S2/MgS2向结晶Li2S/MgS转化的缓慢动力学。
过电位因硫化物的电子接触不足而放大,这也源于硫转化为Li2S(181%)和MgS(在乌兹体中为171%,在岩盐结构中为133%)过程中的体积膨胀,导致Li2S 它与Li+或MgS的Mg2+的导电性差。
虽然有争议,但发生的过电位被认为阻碍了S阴极的充分放电。为了保持与硫和硫化物的高度电子接触,活性材料被嵌入具有高表面积的碳主结构中。
与电解质类似,大量的碳结构有利于每质量的硫的高放电容量。相反,当考虑整个复合阴极时,比容量会受到大量碳的负面影响。
在充电过程中,Li2S/MgS再氧化的大活化障碍相当于一个大的过电位,容易导致不完整的充电反应。因此,将放电过程限制在MgS2上可以大大降低过电位,提高S阴极的可逆性。
由于二价Mg2+与硫化物阴离子有较高的静电作用,多硫化物中间产物的形成不像单价Li+阳离子那样有利,所以在硫磺镁电池的情况下,充电过程中的过电位更加明显。
因此,在含有Mg2+的电解液中加入Li+可以降低充电过程中的过电位,提高S阴极的整体可逆性。
同样,可以证明,在化学制备的Li和Mg多硫化物溶液的氧化过程中,在含Mg的电解质中更强的阳离子-多硫化物相互作用导致其氧化成硫的过电位高于含Li的电解质中的过电位。
相反,在高介电常数的溶剂(如DMSO)中,Mg2+阳离子的有效溶剂络合减少了阳离子-多硫化物的相互作用,降低了多硫化物的氧化电位。

在另一种方法中,已经证明在S阴极存在金属铜会导致较低的过电位和较高的容量保持。因此,观察到了CuS的形成。在有Mg2+存在的放电过程中,CuS被还原成Cu和MgS,而在充电过程中再次形成CuS。
经过反复循环,Cu的反应性实际上将S阴极转变为CuS阴极。因此,这些系统在本文中不作为镁硫电池来讨论。
此外,尽管该系统显示出比S到MgS的转换更低的过电位,但这种CuS阴极的理论比容量(561 mAh g-1)比S阴极(1672 mAh g-1)低三倍。
多硫化物扩散和金属阳极反应
在LSB和硫磺镁电池中,S阴极在循环时往往表现出明显的容量衰减。除了可能不可逆的Li2S/MgS的形成,容量衰减还与硫和溶解的多硫化物扩散到电解液中有关。
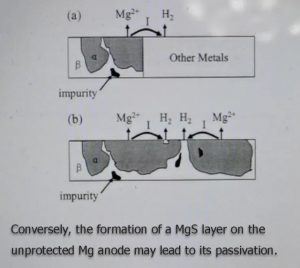
如果它们到达金属阳极,这些物种的还原性分解会进一步导致阳极活性物质的损失。尽管仍然受到影响,但锂金属阳极基本上可以通过SEI得到保护。相反,在未受保护的镁阳极上形成的MgS层可能导致其钝化。
如果低电荷密度的硫或多硫化物(如S62-、S82-)仅部分地被还原成高电荷密度的多硫化物(如S42-),这些物种可以扩散回正极以被再生氧化。
这种氧化还原穿梭机制与电池内部的二次电流相对应,特别是在充电期间。尽管在LSB中是众所周知的,但这些现象也出现在Mg类似物中。由于多硫化镁的溶解度较低,这种副反应在镁硫电池中可能不太明显。
作为LSB研究的主要方向,已经研究了许多多孔碳结构和添加剂,以防止硫和溶解的多硫化物扩散到电解质中。其中许多结构也适用于硫磺镁电池。
此外,已经证明,通过修改分离器和凝胶聚合物电解质,可以减少多硫化物在电解质中的扩散。

然而,除了应用为保留多硫化锂而开发的相同材料外,未来的镁硫电池研究可能会利用Mg2+阳离子的高静电吸引力,将其附着在碳结构的功能团上。
对于LSB,至少已经研究了三种替代方法来抑制多硫化物的溶解和形成:
(i) 通过添加氟化辅助溶剂,使用少量的溶解电解质,或使用所谓的盐中溶剂(溶解的离子液体)电解质、
(ii) 通过在溶剂分子较窄的微孔中浸渍硫,或用半透性阴极封闭孔隙,避免多硫化物的溶解电解质间相(CEI)、
(iii) 通过使用陶瓷电解质(如硫化物玻璃)来避免形成多硫化物的中间体。由于所有这些方法都会增加硫磺阴极的过电位,所以人们认为它们会进一步增加硫磺镁电池中S阴极的过电位。
由于多硫化镁的溶解度低,目前的镁硫电池研究可能与第一种方法类似。然而,第二和第三种方法将受到固体中Mg2+低流动性的挑战。
锂硫电池与镁硫电池的性能和成本对比
在实际的LSB和硫磺镁电池电池中,两种金属阳极和硫磺阴极在以Li+或Mg2+为基础的电解质中的不同特性反映在电池的整体性能参数上,如充放电率能力、电压效率和循环寿命。
本节对目前LSB和硫磺镁电池的几个关键性能参数进行了直接比较。这里说明了镁硫电池的高过电压与低电压效率的关系,这将导致高运营成本。
本节的其余部分介绍了LSB和镁硫电池在实际堆栈水平上的能量密度和材料成本的估计。
镁硫电池的实际可实现的能量密度比LSB低得多,甚至可能不超过最先进的LIB。进一步强调的是,在充放电过程中实现较低的过电位和极低的E:S比率是需要比LIBs更经济的。
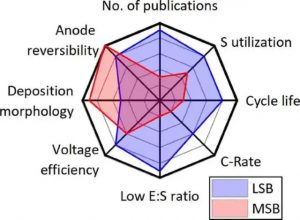
图4:最先进的LSB和镁硫电池的电池特性和性能参数。
图4提供了文献中通常提出的一系列电池特性和性能参数的概述。在这个比较中,需要注意的是,硫磺阴极在镁电解质中的首次可逆放电和充电是在2011年才被证明的,而LSB从20世纪60年代开始就被研究。
在图4中,这主要是基于Chung和Manthiram对LSB和镁硫电池文献的系统总结的数值,出版物的数量要少很多。因此,对目前文献的比较相当于LSB和镁硫电池研究的最先进水平,但不一定表明它们的未来潜力。
正如前面几节所述,使用常用电解质的金属镁阳极的稳定性(以高达99.9%的库仑可逆性表示)比通常在金属锂阳极中观察到的要高得多。同时,尽管在所有条件下都不是无树枝状的,但镁的沉积形态往往比观察到的锂的沉积形态更均匀。
然而,当涉及到过电位时,Mg金属阳极和Mg电解质中的硫阴极显示出明显高于LSB观察到的值。在电池层面,1.3V的平均放电电压和2.0V的平均充电电压之间的滞后导致电压效率只有65%。
对于LSB来说,放电时2.1V的平均电压与充电时2.3V的平均电压的比率将实现高达91%的电压效率。当乘以库仑效率,包括充电和放电期间的容量损失时,所产生的能量效率将对应一个较低的值。
在长期运行过程中,目前镁硫电池非常低的能量效率会累积成高能量损失,特别是与高能量效率的LIB相比,但也与LSB相比,这将导致更高的运行成本。
图4进一步显示了硫磺镁电池中硫磺阴极较低的放电容量和可逆性是如何反映在整个电池性能中的。首先,硫的利用率,即阴极的放电容量,当以每质量的硫(mAh gS-1)表示时,与硫的理论容量有关,在目前的镁硫电池研究中报告,一般明显低于LSB文献中观察到的到达。
其次,在硫磺镁电池中观察到硫磺阴极的容量衰减较快。虽然在锂基电解质中,多个文献已经证明了高达1000次的循环,但到目前为止,S阴极的可逆操作只在镁基电解质中证明了约100次的循环。
此外,镁硫电池的研究只显示了0.01 C和0.1 C之间的充放电率,而LSB的充放电率已经超过了1 C。最后,如上所述,镁硫电池研究中的E:S比率为60:1或更高,而LSB,E:S比率低于3:1,已经证明了稳定的运行。
容量
对于实用的LSB和硫磺镁电池的容量,不仅需要S阴极达到可逆的放电容量(以mAhgS-1表示)和整体的平均放电电压,还需要包括所有非活性材料的重量和体积。”
考虑到Li、Mg和S是相当轻的活性材料,散装电解质、集流器和碳主结构的重量对实用LSB和镁硫电池的总比能量有更大的影响。例如,LIBs或固态电池(SSBs)的情况就是如此。
例如,在E:S比为3:1的情况下,实用LSB和硫磺镁电池电池可能只达到理论比能量的11%左右,而在实用LIB或SSB电池的情况下,分别为43%和36% 理论比能量。由于不同电池成分的容量衰减和循环寿命不同,在循环过程中,容量可能进一步发生不同的变化。
图5:LSB和镁硫电池的比能量和成本估算
图5a-c说明了实际LSB和镁硫电池的比能量是如何由E:S比率(mLgS-1)和电极上的硫负荷(mgcm-2)决定的。在镁硫电池的情况下,通常观察到的平均放电电压为1.3V,与假设平均放电电压为1.7V的电池相比,在镁阳极和S阴极可以降低很大的幅度。
对于LSB,使用了2.1V的平均放电电压。显示的数值对应于电池组水平,因此不包括软包、棱柱形或圆柱形电池外壳的重量。为了与最先进的LIBs的容量进行比较。
参照石墨-锂镍钴铝氧化物(NCA)电池的估计比能量,虽然显示出与石墨-锂镍锰钴氧化物(NMC811)电池相似的比能量,但石墨-NCA电池的容量超过了基于NMC622或NMC111的电池。
按照Betz等人的方法,假设正极采用硫含量为70wt.%的S/C复合材料,放电容量为1200 mAh gS-1。这里,典型的阴极厚度为100微米,相当于5.8mg cm-2的硫磺负载。这些假设被认为是乐观的,特别是对于镁硫电池。对于锂阳极,考虑100%的锂过量以补偿与电解液的反应,而对于反应性较差的镁阳极,没有计算过量。
因此,E:S比为3:1和2:1的LSB在硫含量为5.8mgcm-2时分别提供了394 Wh kg-1和467 Wh kg-1(图5a)。当进一步计算18650电池盒的重量时,如果LSB的E:S比例为3:1和2:1,这些数值分别减少到283 Wh kg-1和339 Wh kg-1。
基于一组假设,对应于石墨-NCALIB电池层面的比能量为314 Wh kg-1,电池层面为264 Wh kg-1。总之,E:S比为3:1和2:1的18650LSB电池将大大超过石墨-NCA电池的容量。
由于每个电池组的18650电池外壳的体积重量很高,使用小袋电池将导致LSB的比能量更高。然而,与硬壳电池外壳不同,小袋电池不允许有太多多余的液体电解质,以防止它们失去形状和稳定性。
镁硫电池通常观察到放电电压为1.3V或更低,E:S比为60:1或更高,对应的比能量值为23Wh kg-1或更低。然而,对于3:1和2:1的低E:S比率,在5.8mg cm-2的硫负载下,可以达到235 Wh kg-1和282 Wh kg-1的比能量(图5b)。
在18650电池中,这些数值对应的容量为178 Wh kg-1和217 Wh kg-1。即使是如此低的E:S比率,镁硫电池也会显示出比石墨-NCALIB低的比能量。
相比之下,E:S比为3:1和2:1的镁硫电池在电池组层面可以达到308Wh kg-1和369Wh kg-1(图5c),18650假设平均放电电压为1.7V,电池中的Wh kg-1和284Wh kg-1。对于LSB来说,在袋装电池的情况下,这种镁硫电池的比能量被认为更高。
然而,正如在电池组水平上所显示的,镁硫电池需要大大降低过电位和在放电过程中非常低的E:S比率,以达到与石墨-NCALIB相似甚至更高的比能量。
成本
根据LSB和硫磺镁电池的比能量,我们还估算了与硫磺负载相关的E:S比率和每千瓦时的材料成本。对于锂和镁的电解质,假设成本与BatPaC中1.2-M LiPF6为基础的电解质相同(15$ L-1)。
尽管镁阳极特别需要特定的高纯度电解质溶液。根据美国地质调查局的数据,硫的价格是0.05美元/千克,金属镁的价格是5.2美元/千克。
与镁相比,金属锂与空气和水分的高反应性以及金属锂对生产设备的粘附性被认为会导致金属锂的生产成本提高,特别是在薄金属箔的情况下(如67微米的200微米)。正极容量的硫含量百分比为5.8毫克厘米2。
与Schmuch等人对LIB和SSB技术的综合成本估计一样,在这项研究中,较低的价格估计为250美元/公斤,而较高的价格估计为1000美元/公斤。相比之下,对于镁来说,假设生产薄的金属箔(例如,对于100%的阴极容量,硫含量为5.8 mgcm-2的19 µm)并不会显著增加成本。
在图5d-f中,LSB和硫磺镁电池的材料价格与目前研究的几种LIB技术的成本范围(在电池组层面)进行了比较。虽然石墨-NMC622电池对应的数值较高,为≈80千瓦时,但硅/石墨-锂和富锰NMC电池代表较低的数值,为≈50千瓦时。
对于LSB,金属锂的低成本估计,硫含量为5.8mg cm-2,E:S比为2:1至3:1的电池组的材料成本估计为87-93美元kWh-1,如果高成本估计为272-278美元kWh-1(图5d)。

虽然C/S阴极只贡献了1.30美元/千瓦时,但在锂成本低至250美元/公斤时,金属锂阳极贡献了62美元/千瓦时。对于1000美元/公斤的高成本估计,仅负极就相当于247美元/千瓦时的成本。
对于2:1至3:1的E:S比率,电解液的成本为12 ~ 18美元/千瓦时-1,而其他非活性材料的总成本为13美元/千瓦时-1。
因此,镁和硫的电极材料的低成本几乎没有反映在每千瓦时的总材料成本中。一方面,在基于镁硫电池的电池组层面,这是一个相对较低的比能量。另一方面,与锂离子电池中的活性材料相比,在镁硫电池中使用大量的非活性材料,其成本优势就会减少。
当包括其他非活性材料(如电池外壳)的成本和电池生产的成本,预处理和极其清洁的环境可能需要避免金属镁阳极的钝化,镁和S电极材料的成本优势将进一步降低。
镁硫电池中可接受的E:S比例
考虑到目前镁硫电池的研究是以60:1或更高的E:S比率进行的,这相当于30kWh kg-1或更低的实际能量密度(图5b)。将电解质质量比降低到3:1或甚至2:1是一个巨大的挑战。
例如,从分子的角度来看,每克硫与3毫升二甲醚的比例相当于每个硫原子约1个溶剂分子,或每个S42-物种约4个溶剂分子。
换句话说,每3毫升溶剂中的1克硫对应的S42-或S82-浓度分别为2.6M和1.3M。而对于Li2S8,在TEGDME中观察到的溶解度为6M,例如,MgS8在THF、DME和TEGDME中的溶解度小于100mM。
为了实现与LIB相似的比能量和更低的成本的镁硫电池,需要开发多硫化镁溶解度更高的电解质配方。
镁硫电池的前景
在对HMDSMgCl/AlCl3-和MgHMDS2/MgCl2/AlCl3-基电解质(HMDS=六甲基二硅氮化物)进行初步研究后,在MgCl2/AlCl3-、MgTFSI2/MgCl2-和Mg[B(ORF)4] 2基电解质(RF=含氟烷基)中也证明了镁硫电池的可逆现象。
同时,从LSB中已知的几种硫/碳复合材料已经成功地应用于镁硫电池的研究,并研究了S阴极在镁电解质中充放电过程中的电化学过程。
然而,从批判的角度来看,本文认为将最先进的镁硫电池技术发展为实用的电池技术,还有很长的路要走。
首先,由于充电(2.0V)和放电(1.3V)时的高电压滞后,镁硫电池的充放电电流电压效率将低于65%,导致效率降低。其次,由于这种滞后现象,以及60:1或更高的E:S比率,目前镁硫电池的能量密度在实际电池组水平上将低至23kWh kg-1。

为了提高电压和效率,使硫磺镁电池的实际能量含量达到与锂离子电池相当的水平,未来的研究应该集中在以下讨论的方法上。关键的研究方向应致力于电解质的设计。
作为首要任务,镁硫电池的研究应集中于降低两个电极的过电位。在镁阳极,电沉积和溶解的过电位可以通过降低Mg2+的强脱溶障碍来改善,例如通过Mg2+与Cl物种的复合。
同时,应通过电解液的预处理消除电解液中的可还原杂质,如使用Bu2Mg14,20等还原性物质,以避免电极表面膜的形成。为了使电池行为不受调整,应进一步制备具有理想化学计量的电解质。
在S阴极,通过减少Mg2+-多硫化物的静电作用和稳定Mg多硫化物的形成,可以改善S阴极在Mg电解液中放电和充电时的过电位。
尽管在镁阳极上不稳定,但在高介电常数的溶剂(如DMSO和DMF)中,多硫化镁的稳定性更高,可以通过利用中间多硫化物的形成提高平均放电电位。
在充电过程中,多硫化物的中间形成降低了MgS氧化为硫的过电位。同样,已经发现S阴极的过电位随不同的醚而变化,并可能通过Mg2+阳离子与Cl物种的复合而进一步降低。
第二,为了实现与LIB相当的实际比能量值,镁硫电池的研究应该集中在实现极低的E:S比。正如本观点所指出的,多硫化镁在普通醚中的溶解度比多硫化锂小得多,最终在E:S比为3:1时,多硫化物的溶解度不够。
因此,硫磺镁电池的研究应着重于开发多硫化镁溶解度更高的电解质。但与此同时,这种方法不应促进多硫化物向镁阳极扩散,以避免形成钝化膜。
因此,硫磺镁电池的研究应该集中在新的方法上,将溶解的多硫化镁物种锚定或限制在阴极结构中或阴极处。与LSB研究不同,Mg2+与表面基团的高静电相互作用可能会开辟新的策略。

最后,必须考虑技术准备水平(TRL)。LIB是各种市场上成熟的高能量密度基准技术,而LSB目前正在进入市场,而镁硫电池正处于非常基础的研究阶段,因此锂离子电池被用于许多场景,如高尔夫车锂电池、电动滑板电池等。
尽管实用的镁硫电池电池的比能量密度可能仍然低于LIBs和LSBs,但现在说镁硫电池能否发展成为这些技术的更经济和可持续的替代品还为时尚早。
与LIBs和LSBs不同,镁硫电池在电极材料成本、丰富的资源和更环保的活性材料方面具有相当的竞争力。这样的系统对于可再生能源更可持续地融入电网具有很大的意义。